证券时报e公司消息,新冠自测会不会在国内实行,一直备受社会关注。1月10日晚,“大牛股”九安医疗(002432)在互动平台上披露的信息显示,国内新冠自测胎动,天津正在研究“九安医疗版”的自测建议。
天津正在研究新冠自测建议
天津率先查出本土奥密克戎变异株的消息,在国内引起了不小的担忧。1月10日举行的天津市新型冠状病毒肺炎疫情防控工作新闻发布会,天津市政府副秘书长、市卫生健康委主任顾清介绍,截至目前,天津市本轮疫情累计报告本土确诊病例31例、无症状感染者10例。其他新增初筛阳性感染者待临床专家组进一步核验后进行通报。 截至1月10日15时,天津已累计判定追踪密切接触者1152人、次级密切接触者685人,均予以隔离管控。全部涉疫场所均实施终末消毒。天津本轮疫情已累计隔离管理约7.5万人。
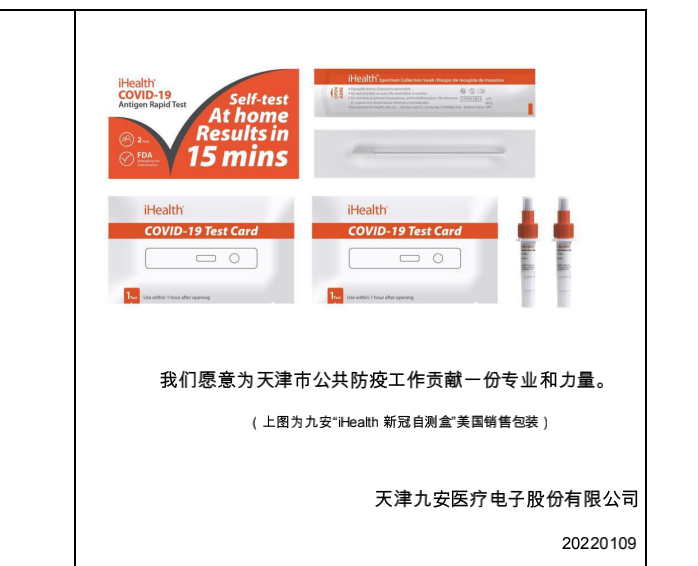
● 针对奥密克戎变异病毒,天津上市公司——九安医疗有检测试剂,2022年1月5日,该公司收到了iHealth新冠抗原家用自测OTC试剂盒针对Omicron变异病毒的测试性能实验报告。报告显示,该OTC试剂盒在实验中100%检测出了最大CT值为21.59(n=5)的Omicron活性病毒样本。
同时,在1月10日披露的投资者关系活动记录表中,针对问及的“德尔塔克戎”毒株,公司是否有做准备,九安医疗表示,公司正在密切关注该变异毒株,并会尽快对其开展生物信息学比对,实时启动重组N蛋白测试以及在获得变异毒株后进行测试性能实验等相关验证。 值得注意的是,证券时报·e公司发现,在这份投资者关系活动记录表,还透露了一个重要信息——九安医疗已经向天津市疫情防控指挥部提交了《关于采用家庭自测盒实现奥密克戎新冠防疫1+1的建议》。

● 九安医疗表示,奥密克戎变异病毒的传染性强,现在欧美地区检测呈阳性的患者数目均在大幅上升,根据英国人体抗毒实验最新发表的文章来看,患者在PCR检验能够检测出阳性之前,有的就已经具有了排毒能力。其实排队刷核酸的过程本身也是一种暴露,首先,排队过程可能延续数小时,其次,排队时人与人之间的安全距离很难严格控制。基于此,公司已经向天津市疫情防控指挥部提交了《关于采用家庭自测盒实现奥密克戎新冠防疫1+1的建议》。

家庭自测盒,也就是大家俗称的新冠自测(抗原试剂)。目前,在筛查新冠感染者方式,国内采用的方式是核酸检测,而欧美等海外国家正在大量采用新冠自测。若九安医疗的自测建议能被采纳,将意味着国内筛查新冠感染者方式,将会发生重要变化。
当前,我国疫情防控取得重大战略成果,这背后自然也离不开核酸检测的功劳。不过,随着新冠防疫形势的变化,自测优势的显现,聚集性疫情暴露出防控短板和薄弱环节,以及减少社会活动对经济活动的影响,调整新冠检测方式的呼吁不乏支持者。 这份投资者关系活动记录表还透露,天津市有关部门正在研究九安医疗的上述方案。虽然最终能否被采纳不得而知,但释放的信号值得重视。

新冠自测已成欧美主要手段
新冠自测试剂,用的是抗原试剂,而非核酸试剂。 据悉,抗原试剂集合了核酸试剂早期诊断准确率高和抗体试剂快速检测的特点,在感染新冠病毒的第一天就能检测出来,操作简便,不需要专用设备或仪器,从采样到出结果一般在20分钟以内,准确率接近核酸试剂。因此,美、英等国家将抗原试剂作为新冠筛查的主要手段后,筛查效率明显提高。 早在2020年11月,英国就在利物浦试点以抗原试剂等方式开展首次全民新冠病毒“普测”。同时,利物浦也会对疑似病例配合采用更可靠的核酸测试。英国首相鲍里斯称,这种大规模测试是对抗新冠的强大新武器。在开展这项普测后,当地隔离的时间也将从14天缩短为7天。 实际上,美、英、法、德等国家,已将抗原试剂作为复工复学,机场、车站等人流密集场所,发热门诊筛查新冠感染者的主要手段。
● 美国FDA在其官网上,对抗原检测试剂盒针对检测奥密克戎变异病毒有效性的情况描述是:FDA正在与NIH合作RADx项目,使用感染奥密克戎变异病毒患者样本,研究抗原检测试剂盒的表现。RADx近期经过初步研究评估了一些抗原检测试剂盒在检测被感染病患的活性病毒样本的表现,这是短期内评估其真实性检测表现的最好办法。早期数据显示抗原检测试剂盒可以检测奥密克戎变异病毒,但其灵敏度可能降低。
随着新冠病例,尤其是感染变异新冠病毒奥密克戎毒株病例激增,海外对产自中国的检测盒自需求也开始增加。 海关数据统计显示,2021年11月我国HS编码30021500的诊断试剂(主要为新冠抗原试剂)出口货值达到41.65亿元,环比10月增长80.62%,为连续6个月下降后,首次出现环比增长。 美国2021年1月3日新增新冠确诊病例突破100万例,估计其中超过95%感染了新冠变异株奥密克戎毒株。面对新增病例飙升局面,美国新冠病毒检测能力捉襟见肘。在此背景之下,美国政府于1月4日宣布,即将签署5亿份新冠病毒快速检测盒采购合同,到货后免费发放给有需求的民众。
自测认证含金量不同
目前,国内涉及家用新冠检测业务的上市公司较多,包括九安医疗、东方生物、热景生物、万浮生物、奥泰生物、博拓生物、安旭生物、亚辉龙、明德生物、硕世生物等。 从上述公司自测试剂的性质来,绝大部分为欧盟CE认证。譬如,硕世生物去年12月公告新冠病毒抗原快速检测试剂盒(自检)取得欧盟CE认证;万孚生物新冠病毒抗原自测试剂盒于去年6月获得欧盟CE认证,已在欧洲、亚洲、中东、拉美等多个国家和地区实现了销售;热景生物新冠抗原自测产品获得德国BfArM、英国MHRA、泰国TFDA注册批准。
● 中国海关数据显示,从出口市场来看,2021年11月中国新冠抗原试剂主要销往德国、英国、美国、加拿大、希腊。其中德国11月进口13.08亿元,环比增长179.24%,超过英国成为我国新冠检测试剂第一大进口国。英国和美国进口量居第二、第三位,进口量分别达到7.15亿元、3.46亿元,分别环比增长27.58%、179.24%。
从上述出口数量不难看出,不论是感染者人数,还是需要检测的人群,美国对自测试剂的用量,要远大于英国和德国。但出口美国的抗原试剂,反而低于英国和德国,背后的原因就是获得美国FDA授权的国内试剂企业非常少。 众所周知,FDA的认证在全球最为苛刻。目前,获得美国FDA批准,产品用于新冠居家自测国内企业只有3家,分别是九安医疗、东方生物和艾康生物。 在等待检测时,大量人群跑到街上去聚集、等待测核酸,往往是增加了新冠病毒传播的风险。为何国内上市公司的新冠自测产品能够出口海外、供外国人使用,为何国人就不能够使用相关抗原试剂产品来自测?答案就是国内尚未有新冠抗原试剂获得注册。 目前,国内新发病例较少,且较为零散,试剂生产企业很难按照国家药监局目前的规定,在3个临床机构归集到足够的临床试验病例,类似于新冠疫苗在国内难以开展三期临床试验的情形。 在业界看来,按照FDA的EUA注册要求,拿到认证的九安医疗、东方生物和艾康科技,已经在美国完成了新冠抗原试剂临床试验。FDA的审批在全球最审慎,紧急情况下,国内抗原试剂的注册,应该允许相关企业引用海外数据,从而提高临床试验、审批效率。安信证券马帅表示,回顾欧洲、美国过去两年每月新增检测数量,新型变异毒株的出现、家庭自测产品的推广、隔离政策的放开对新冠检测市场规模已经起到了较大的推动作用。随着Omicron的传播、美国进一步推广家庭自检产品以及1月份即将到来的春季学期,都将持续刺激新冠检测需求。基于对未来行业趋势的判断,预计2022年欧洲与美国合计新冠检测市场规模有望达到33.91亿美元,折合人民币约220亿元。
原标题:奥密克戎将能自测?九安医疗向天津提建议:采用家庭自测盒实现奥密克戎新冠防疫!
【免责声明】上游新闻客户端未标有“来源:上游新闻”或“上游新闻LOGO、水印的文字、图片、音频视”等稿件均为转载稿。如转载稿涉及版权等问题,请联系上游。